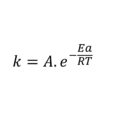La tabla de potenciales de reducción muestra los diferentes potenciales de reducción de algunas de las reacciones químicas más utilizadas cuando éstas se desarrollan en condiciones estándar.
Cuando se habla de reacciones químicas que involucran la transferencia de electrones es necesario tener en cuenta la rama de la química llamada electroquímica.
A partir de la electroquímica y utilizando un electrodo de hidrógeno se realizaron en el laboratorio diferentes reacciones y se midió el potencial de reducción estándar E°.
Los resultados que a continuación se presentan se puede aplicar para un gran número de fenomenos fisicoquímicos pero su función principal es establecer el potencial de reducción real a partir de la ecuación de Nernst
La tabla contiene reactivos, productos y la energía en voltios:
| Reactivos | → | Productos | E° (V) |
| Li+(aq) + e− | → | Li(s) | −3.05 |
| Rb+(aq) + e− | → | Rb(s) | −2.98 |
| K+(aq) + e− | → | K(s) | −2.93 |
| Cs+(aq) + e− | → | Cs(s) | −2.92 |
| Ba2+(aq) + 2e− | → | Ba(s) | −2.91 |
| Sr2+(aq) + 2e− | → | Sr(s) | −2.89 |
| Be2+(aq) + 2e− | → | Be(s) | −2.76 |
| Na+(aq) + e− | → | Na(s) | −2.71 |
| Mg2+(aq) + 2e− | → | Mg(s) | −2.38 |
| H2 + 2e− | → | 2H− | −2.25 |
| Ca2+(aq) + 2e− | → | Ca(s) | −1.85 |
| Al3+(aq) + 3e− | → | Al(s) | −1.66 |
| Ti2+(aq) + 2e− | → | Ti(s) | −1.63 |
| TiO(s) + 2H+ + 2e− | → | Ti(s) + H2O | −1.31 |
| Ti2O3(s) + 2H+ + 2e− | → | 2TiO(s) + H2O | −1.23 |
| Ti3+(aq) + 3e− | → | Ti(s) | −1.21 |
| Mn2+(aq) + 2e− | → | Mn(s) | −1.18 |
| V2+(aq) + 2e− | → | V(s) | −1.13 |
| Sn(s) + 4H+ + 4e− | → | SnH4(g) | −1.07 |
| SiO2(s) + 4H+ + 4e− | → | Si(s) + 2H2O | −0.91 |
| B(OH)3(aq) + 3H+ + 3e− | → | B(s) + 3H2O | −0.89 |
| TiO2+(aq) + 2H+ + 4e− | → | Ti(s) + H2O | −0.86 |
| 2 H2O(l) + 2e– | → | H2(g) + 2 OH–(aq) | −0.83 |
| Zn2+(aq) + 2e− | → | Zn(s) | −0.76 |
| Cr3+(aq) + 3e− | → | Cr(s) | −0.74 |
| Au(CN)2–(aq) + e– | → | Au(s) +2 CN–(aq) | −0.60 |
| 2TiO2(s) + 2H+ + 2e− | → | Ti2O3(s) + H2O | −0.56 |
| Ga3+(aq) + 3e− | → | Ga(s) | −0.53 |
| H3PO2(aq) + H+ + e− | → | P(s) + 2H2O | −0.51 |
| H3PO3(aq) + 3H+ + 3e− | → | P(s) + 3H2O | −0.50 |
| H3PO3(aq) + 2H+ + 2e− | → | H3PO2(aq) + H2O | −0.50 |
| Fe2+(aq) + 2e− | → | Fe(s) | −0.44 |
| 2CO2(g) + 2H+(aq) + 2e– | → | HOOCCOOH(aq) | −0.43 |
| Cr3+(aq) + e− | → | Cr2+(aq) | −0.42 |
| Cd2+(aq) + 2e− | → | Cd(s) | −0.40 |
| PbSO4(s) + 2e– | → | Pb(s) +SO42-(aq) | −0.36 |
| GeO2(s) + 2H+ + 2e− | → | GeO(s) + H2O | −0.37 |
| In3+(aq) + 3e− | → | In(s) | −0.34 |
| Tl+(aq) + e− | → | Tl(s) | −0.34 |
| Ge(s) + 4H+ + 4e− | → | GeH4(g) | −0.29 |
| Co2+(aq) + 2e | → | Co(s) | −0.28 |
| H3PO4(aq) + 2H+ + 2e− | → | H3PO3(aq) + H2O | −0.28 |
| V3+(aq) + e− | → | V2+(aq) | −0.26 |
| Ni2+(aq) + 2e− | → | Ni(s) | −0.25 |
| As(s) + 3H+ + 3e− | → | AsH3(g) | −0.23 |
| MoO2(s) + 4H+ + 4e− | → | Mo(s) + 2H2O | −0.15 |
| Si(s) + 4H+ + 4e− | → | SiH4(g) | −0.14 |
| Sn2+(aq) + 2e− | → | Sn(s) | −0.14 |
| O2(g) + H+ + e− | → | HO2•(aq) | −0.13 |
| Pb2+(aq) + 2e− | → | Pb(s) | −0.13 |
| WO2(s) + 4H+ + 4e− | → | W(s) | −0.12 |
| CO2(g) + 2H+ + 2e− | → | HCOOH(aq) | −0.11 |
| Se(s) + 2H+ + 2e− | → | H2Se(g) | −0.11 |
| CO2(g) + 2H+ + 2e− | → | CO(g) + H2O | −0.11 |
| SnO(s) + 2H+ + 2e− | → | Sn(s) + H2O | −0.10 |
| SnO2(s) + 2H+ + 2e− | → | SnO(s) + H2O | −0.09 |
| WO3(aq) + 6H+ + 6e− | → | W(s) | −0.09 |
| P(s) + 3H+ + 3e− | → | PH3(g) | −0.06 |
| HCOOH(aq) + 2H+ + 2e− | → | HCHO(aq) + H2O | −0.03 |
| 2H+(aq)+ 2e− | → | H2(g) | 0.00 |
| H2MoO4(aq) + 6H+ + 6e− | → | Mo(s) + 4H2O | +0.11 |
| Ge4+(aq) + 4e− | → | Ge(s) | +0.12 |
| C(s) + 4H+ + 4e− | → | CH4(g) | +0.13 |
| HCHO(aq) + 2H+ + 2e− | → | CH3OH(aq) | +0.13 |
| S(s) + 2H+ + 2e− | → | H2S(g) | +0.14 |
| Sn4+(aq) + 2e− | → | Sn2+(aq) | +0.15 |
| Cu2+(aq) + e− | → | Cu+(aq) | +0.16 |
| HSO4−(aq) + 3H+ + 2e− | → | 2H2O(l) + SO2(aq) | +0.16 |
| SO42−(aq) + 4H+ + 2e− | → | 2H2O(l) + SO2(aq) | +0.17 |
| SbO+ + 2H+ + 3e− | → | Sb(s) + H2O | +0.20 |
| H3AsO3(aq) + 3H+ + 3e− | → | As(s) + 3H2O | +0.24 |
| GeO(s) + 2H+ + 2e− | → | Ge(s) + H2O | +0.26 |
| Hg2Cl2 + 2e− | → | 2Hg + 2Cl− | +0.27 |
| Bi3+(aq) + 3e− | → | Bi(s) | +0.32 |
| Cu2+(aq) + 2e− | → | Cu(s) | +0.34 |
| [Fe(CN)6]3−(aq) + e− | → | [Fe(CN)6]4−(aq) | +0.36 |
| VO2+(aq) + 2H+ + e− | → | V3+(aq) + H2O | +0.361 |
| O2(g) + 2H2O(l) + 4e– | → | 4OH–(aq) | +0.40 |
| H2MoO4 + 6H+ + 3e− | → | Mo3+(aq) | +0.43 |
| CH3OH(aq) + 2H+ + 2e− | → | CH4(g) + H2O | +0.50 |
| SO2(aq) + 4H+ + 4e− | → | S(s) + 2H2O | +0.50 |
| Cu+(aq) + e− | → | Cu(s) | +0.52 |
| CO(g) + 2H+ + 2e− | → | C(s) + H2O | +0.52 |
| I2(s) + 2e− | → | 2I−(aq) | +0.54 |
| I3−(aq) + 2e− | → | 3I−(aq) | +0.54 |
| [AuI4]−(aq) + 3e− | → | Au(s) + 4I−(aq) | +0.56 |
| H3AsO4(aq) + 2H+ + 2e− | → | H3AsO3(aq) + H2O | +0.56 |
| [AuI2]−(aq) + e− | → | Au(s) + 2I−(aq) | +0.58 |
| MnO4–(aq) + 2H2O(l) + 3e– | → | MnO2(s) + 4 OH–(aq) | +0.59 |
| S2O32− + 6H+ + 4e− | → | 2S(s) + 3H2O | +0.60 |
| H2MoO4(aq) + 2H+ + 2e− | → | MoO2(s) + 2H2O | +0.65 |
| O2(g) + 2H+ + 2e− | → | H2O2(aq) | +0.70 |
| Tl3+(aq) + 3e− | → | Tl(s) | +0.72 |
| H2SeO3(aq) + 4H+ + 4e− | → | Se(s) + 3H2O | +0.74 |
| Fe3+(aq) + e− | → | Fe2+(aq) | +0.77 |
| Hg22+(aq) + 2e− | → | 2Hg(l) | +0.79 |
| Ag+(aq) + e− | → | Ag(s) | +0.80 |
| NO3–(aq) + 2H+(aq) +e– | → | NO2(g) + H2O(l) | +0.80 |
| [AuBr4]−(aq) + 3e− | → | Au(s) + 4Br−(aq) | +0.85 |
| Hg2+(aq) + 2e− | → | Hg(l) | +0.85 |
| MnO4−(aq) + H+ + e− | → | HMnO4−(aq) | +0.90 |
| 2Hg2+(aq) + 2e− | → | Hg22+(aq) | +0.91 |
| [AuCl4]−(aq) + 3e− | → | Au(s) + 4Cl−(aq) | +0.93 |
| MnO2(s) + 4H+ + e− | → | Mn3+(aq) + 2H2O | +0.95 |
| [AuBr2]−(aq) + e− | → | Au(s) + 2Br−(aq) | +0.96 |
| Br2(l) + 2e− | → | 2Br−(aq) | +1.07 |
| Br2(aq) + 2e− | → | 2Br−(aq) | +1.09 |
| IO3−(aq) + 5H+ + 4e− | → | HIO(aq) + 2H2O | +1.13 |
| [AuCl2]−(aq) + e− | → | Au(s) + 2Cl−(aq) | +1.15 |
| HSeO4−(aq) + 3H+ + 2e− | → | H2SeO3(aq) + H2O | +1.15 |
| Ag2O(s) + 2H+ + 2e− | → | 2Ag(s) | +1.17 |
| ClO3−(aq) + 2H+ + e− | → | ClO2−(g) + H2O | +1.18 |
| ClO2(g) + H+ + e− | → | HClO2(aq) | +1.19 |
| 2IO3−(aq) + 12H+ + 10e− | → | I2(s) + 6H2O | +1.20 |
| ClO4−(aq) + 2H+ + 2e− | → | ClO3−(aq) + H2O | +1.20 |
| O2(g) + 4H+ + 4e− | → | 2H2O | +1.23 |
| MnO2(s) + 4H+ + 2e− | → | Mn2+(aq) + 2H2O | +1.23 |
| Tl3+(aq) + 2e− | → | Tl+(s) | +1.25 |
| Cr2O72−(aq) + 14H+ + 6e− | → | 2Cr3+(aq) + 7H2O | +1.33 |
| Cl2(g) + 2e− | → | 2Cl−(aq) | +1.36 |
| CoO2(s) + 4H+ + e− | → | Co3+(aq) + 2H2O | +1.42 |
| 2HIO(aq) + 2H+ + 2e− | → | I2(s) + 2H2O | +1.44 |
| BrO3−(aq) + 5H+ + 4e− | → | HBrO(aq) + 2H2O | +1.45 |
| 2BrO3− + 12H+ + 10e− | → | Br2(l) + 6H2O | +1.48 |
| 2ClO3− + 12H+ + 10e− | → | Cl2(g) + 6H2O | +1.49 |
| MnO4−(aq) + 8H+ + 5e− | → | Mn2+(aq) + 4H2O | +1.51 |
| O2• + 2H+ + 2e− | → | H2O2(aq) | +1.51 |
| Au3+(aq) + 3e− | → | Au(s) | +1.52 |
| NiO2(s) + 4H+ + 2e− | → | Ni2+(aq) | +1.59 |
| 2HClO(aq) + 2H+ + 2e− | → | Cl2(g) + 2H2O | +1.63 |
| Ag2O3(s) + 6H+ + 4e− | → | 2Ag+(aq) + 3H2O | +1.67 |
| HClO2(aq) + 2H+ + 2e− | → | HClO(aq) + H2O | +1.67 |
| Au+(aq) + 1e− | → | Au(aq) | +1.68 |
| Pb4+(aq) + 2e− | → | Pb2+(aq) | +1.69 |
| MnO4−(aq) + 4H+ + 3e− | → | MnO2(s) + 2H2O | +1.70 |
| H2O2(aq) + 2H+ + 2e− | → | 2H2O | +1.76 |
| AgO(s) + 2H+ + e− | → | Ag+(aq) + H2O | +1.77 |
| Au+(aq) + e− | → | Au(s) | +1.83 |
| BrO4−(aq) + 2H+ + 2e− | → | BrO3−(aq) + H2O | +1.85 |
| Co3+(aq) + e− | → | Co2+(aq) | +1.92 |
| Ag2+(aq) + e− | → | Ag+(aq) | +1.98 |
| S2O82- + 2e– | → | 2SO42- | +2.07 |
| HMnO4(aq) + 3H+ + 2e− | → | MnO2(s) + 2H2O | +2.09 |
| F2(g) + 2e− | → | 2F−(aq) | +2.87 |
| F2(g) + 2H+ + 2e− | → | 2HF(aq) | +3.05 |
La tabla de potenciales de reducción facilita la posibilidad de encontrar los valores de una forma práctica y organizada.
Cada vez que se estudia una reacción y se determina su potencial, la tabla de potenciales de reducción se puede ir actualizando.
De este modo se consigue una formación clara y concisa sobre el tema.
¿Cómo referenciarnos?
Si deseas incluir esta información en alguno de tus trabajos no olvides referenciarnos, puedes hacerlo así:
Munévar, R. (7 de abril de 2024) Tabla de potenciales de reducción. Ecuacionde.com. Recuperado el día/mes/año (inserta aquí la fecha del día que consultas nuestra web) de https://ecuacionde.com/tabla-potenciales-reduccion
Gracias por consultar nuestra página web.