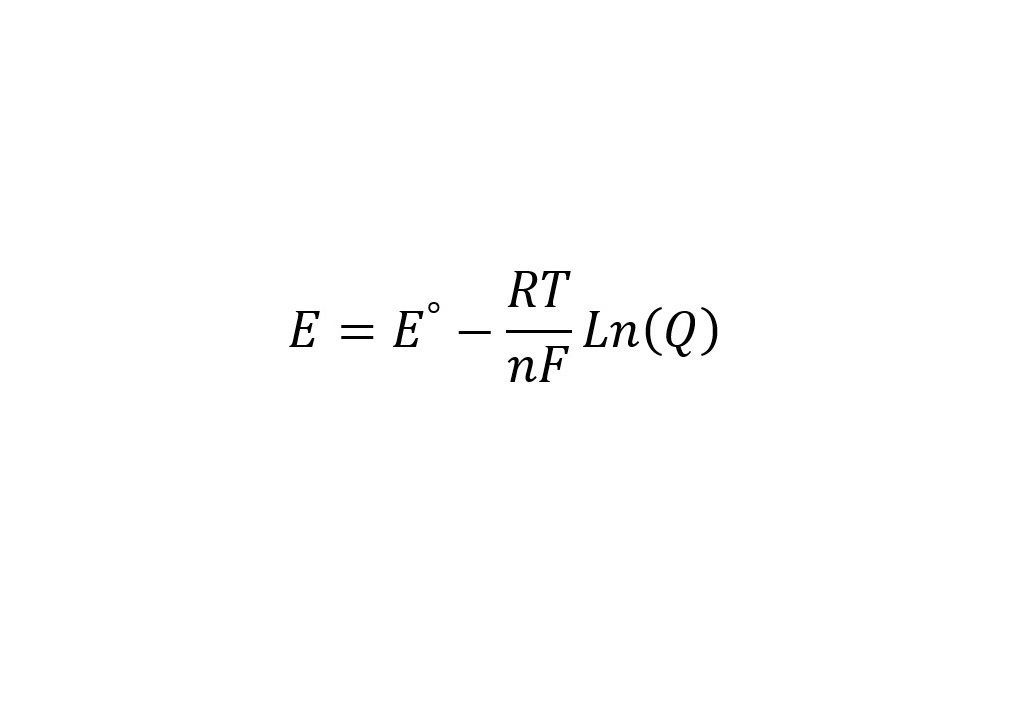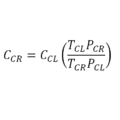La ecuación de Nernst es la expresión matemática que permite el cálculo del potencial de reducción de un electrodo cuando las condiciones no son estándar (concentración de 1M, presión de 1 atm, temperatura de 25°C o 298,15K).
Es ampliamente utilizada en electroquímica y debe su nombre al ciéntifico alemán Walther Nernst quien la formuló en 1889.
Su principal función es establecer una relación entre el potencial estándar de una celda y su potencial real.
Los potenciales estándar y reales son diferentes porque los reales se ven afectados por las concentraciones de los reactivos y productos en la celda.
Tabla de contenidos
Ecuación o fórmula
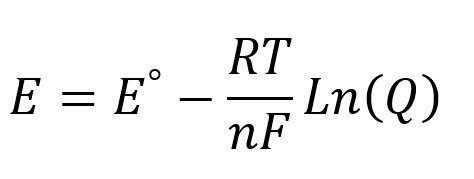
donde,
- E: es el potencial de reducción real del electrodo bajo condiciones no estándar.
- E°: es el potencial en condiciones estándar, este se encuentra tabulado en la literatura para diferentes reacciones de reducción.
- R: es la constante de los gases, en este caso debe estar en Joules sobre mol-Kelvin para que exista una coherencia en las unidades.
- T: es la temperatura en unidades absolutas (Kelvin)
- n: es la cantidad de moles de electrones que participan en la reacción.
- F: es la constante de Faraday (aproximadamente 96500 C/mol)
- Q: es el cociente para la reacción correspondiente.
Relación entre el principio de Le Châtelier y la ecuación de Nernst
El principio de Le Châtelier especifica que cuando se aumenta la concentración de los reactivos, la ecuación se desplaza a la derecha. Así mismo al aumentar la concentración de los productos, se desplaza a la izquierda.
La fuerza impulsora de una reacción viene expresada por la ecuación de Nernst, cuyos dos términos representan la fuerza impulsora en condiciones estándar (E°) y en el término Q se expresa la dependencia de las concentraciones de los reactivos.
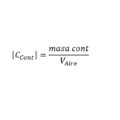
De este modo para una reacción:
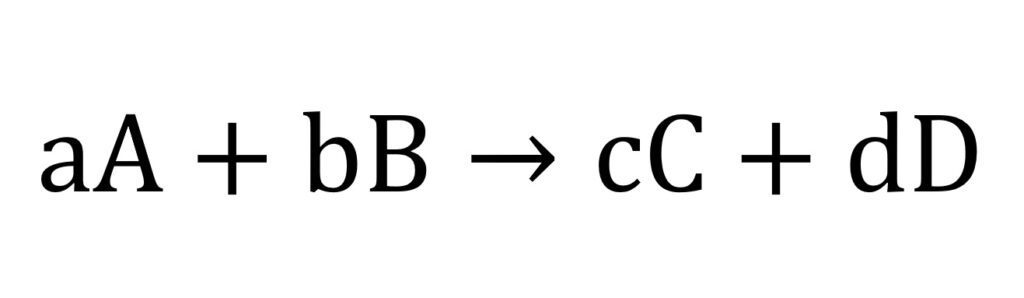
El término Q se expresaría:
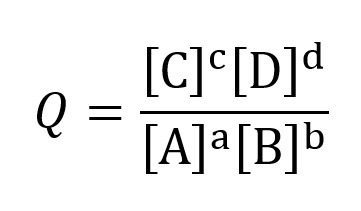
Los términos [C] y [D] expresan la concentración molar de los iones disueltos en las celdas, si la celda funciona con gases la concentración debe expresarse en presiones parciales.
[A] y [B] expresa las concentraciones para los reactivos y se tienen en cuenta las mismas consideraciones que para los productos, cabe resaltar que cuando una de las sustancias se encuentra en estado sólido se considera que la concentración es 1.
Ecuación o fórmula en condiciones estándar
Algunos autores convierten el logaritmo natural (o logaritmo neperiano) en un logaritmo decimal aplicando la siguiente relación:
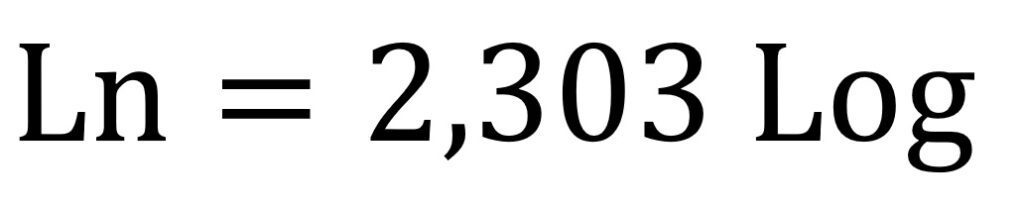
Al evaluarse la ecuación de Nernst en condiciones estándar significa que la temperatura es de 25°C, es decir 298,15 K por lo que reemplazando los valores tendríamos que:
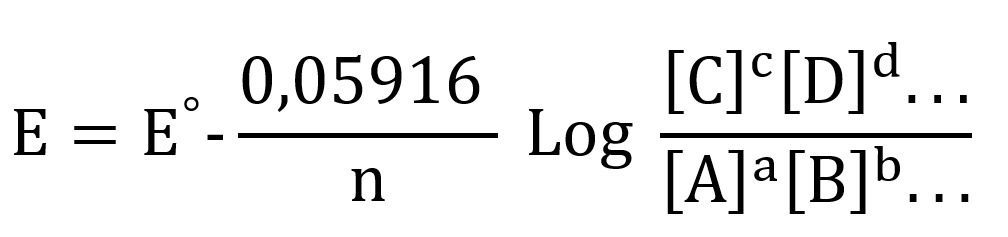
Se debe tener en cuenta que las cantidades de las concentraciones (A,B,C,D… o más) dependerán de la reacción.
Ejemplo con gases
Se desea conocer el potencial E del electrodo cloro, ion cloruro, cuando la presión parcial del cloro gaseoso es de 2 atm y la concentración del ion cloruro es de 0,002 M
Solución
Lo primero que debemos hacer es conocer la reacción y el potencial estándar, para este caso:
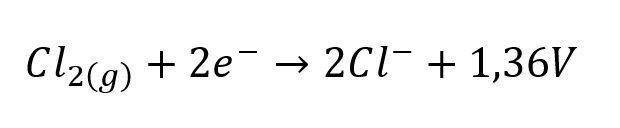
Aplicando la ecuación de Nernst a condiciones estándar tenemos entonces que:
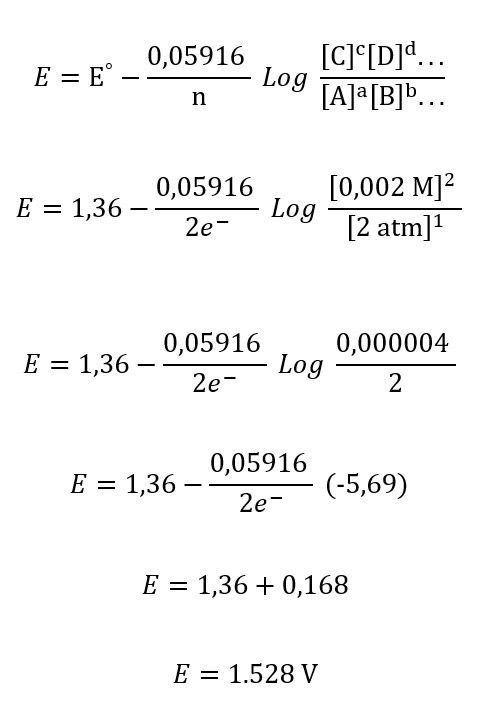
Ecuación de Nernst en una pila o batería
Cuando se tiene una pila es importante conocer que la reacción química que ocurre dentro de la misma es una oxidación-redacción, de este modo para calcular el potencial de reducción se debe calcular el potencial de semirreacción del cátodo y restarle el potencial de semireacción del ánodo, la ecuación de Nernst para pilas o batería queda así:
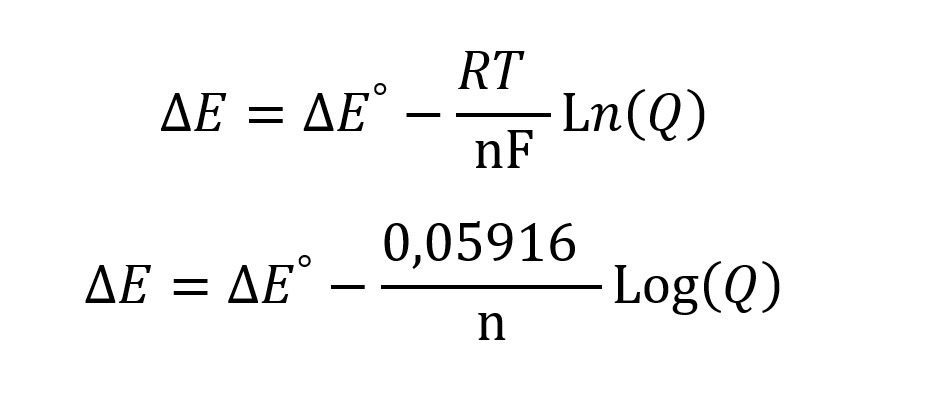
Donde ΔE es el potencial neto de la pila o batería y
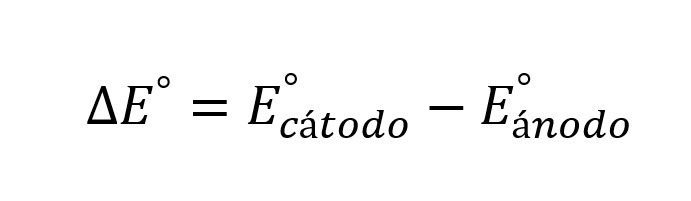
Ejemplo en una pila o batería
Se tiene una pila que funciona con Zinc y Aluminio, cuyo potencial estándar es de 0,9 Voltios y la reacción es:
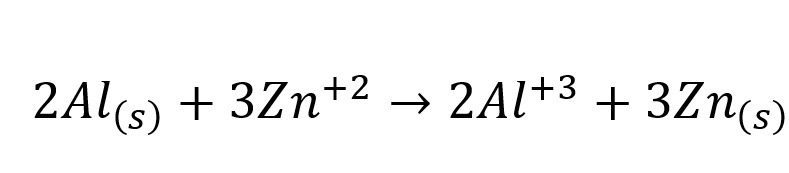
Si la concentración de el ion Zn+2 en los reactivos es de 0,5 M y la concentración del ion Al+3 en los productos es 0,1 M ¿cuál es el potencial de la pila?
Solución:
Lo primero que se debe determinar es la cantidad de electrones que se mueven en la reacción, esto se puede hacer analizando cualquiera de los elementos, para este caso si observamos el Zinc pasa de un estado +2 a un estado 0 (cero), es decir se mueven 2 moles de electrones por cada Zinc, sin embargo como en la reacción se observa que hay 3 moles de Zinc significa que la cantidad de electrones que se mueven son 3 moles de Zinc x 2 moles de electrones por cada mol de Zinc = 6 moles de electrones.
Luego se utiliza la ecuación de Nernst reemplazando los valores, recuerda que cuando los elementos están en estado sólido su concentración es igual a 1, de este modo se tiene:

Tabla de potenciales de reducción
La información de los potenciales de reducción de diferentes reacciones químicas pueden encontrarse en una tabla de potenciales de reducción, aquí te dejamos el enlace para que puedas consultarla.