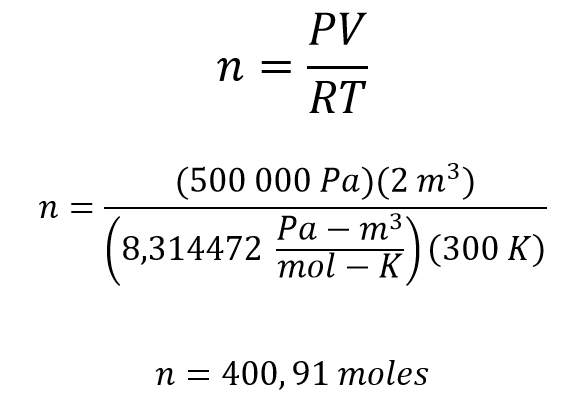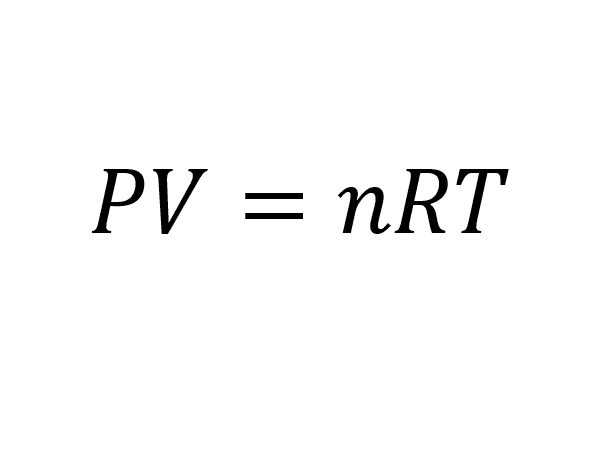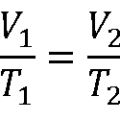La ecuación de gases ideales o ley de gases ideales describe la relación entre la presión y el volumen de un gas en función de la temperatura y el número de moles.
Esta ecuación tiene en cuenta procesos donde hay cambios de presión, cambios de temperatura, cambio en el volumen e incluso cambios en la cantidad de masa.
Tabla de contenidos
Fórmula general de la ley
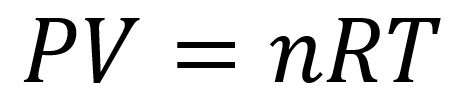
¿Qué es un gas ideal?
Un gas ideal o gas teórico es un conjunto de moléculas en estado gaseoso separadas separadas una de la otra de tal manera que no se ejerce fuerzas intermoleculares entre ellas.
La condición de gas ideal ocurre normalmente a bajas presiones y altas temperaturas lo que permite que cada partícula esté alejada una de la otra con el fin de que no interactúen.
Características de los gases ideales
- Todos están compuestos por átomos o moléculas
- Las moléculas del gas se mueven a altas velocidades
- Si dos moléculas chocan se genera un choque elástico, es decir que no hay pérdidas de energía
- Se dilatan, lo que significa que aumentan de volumen con los aumentos de temperatura
- Son adaptables, no tienen una forma definida sino que adaptan la forma del recipiente que los contiene
- En su gran mayoría, son incoloros e inodoros, es decir no tienen ni color ni olor.
- Son compresibles, lo que significa que disminuyen el volumen a medida que la presión aumenta.
Ejemplos
- Aire
- Dióxido de carbono
- Monóxido de carbono
- Hidrógeno
- Nitrógeno
Explicación de la ley
En 1834 un ingeniero y físico francés llamado Émile Clapeyron dedujo por primera vez la ecuación de los gases ideales tomando como base el trabajo realizado por los científicos Boyle y Charles en sus respectivas ecuaciones.
La determinación de esta ley fue crucial ya que se conocían los comportamientos de un gas ideal en procesos que no cambiaban de masa (número de moles constante) pero hacía falta determinar cómo la cantidad variaba las condiciones como presión, temperatura y volumen.
Teniendo en cuenta los resultados obtenidos se pudo comprobar que la presión y el volumen eran directamente proporcionales a la temperatura y el número de moles, esto permitió conocer las diferentes variables a las cuales puede estar un gas.
De este modo se puede determinar que los gases ideales tienen un comportamiento predecible en cuanto a los cambios de presión y temperatura
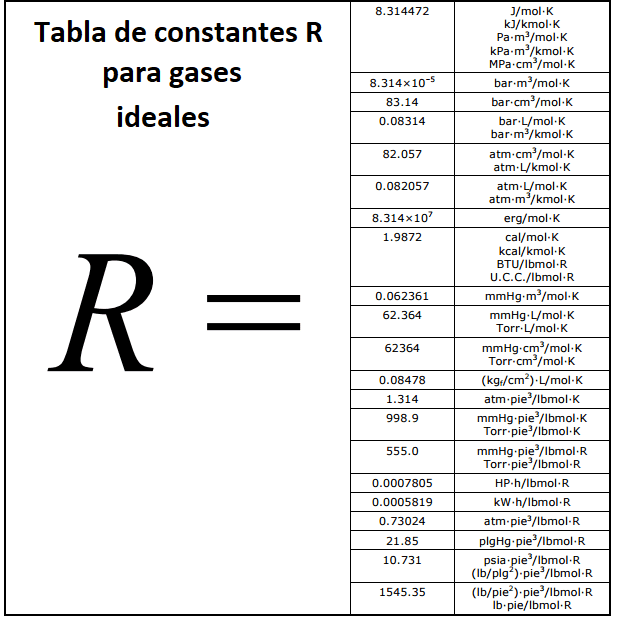
Constante R
La constante R de los gases ideales es la relación que existe entre la presión, la temperatura, el volumen y el número de moles estándar para un gas, esta se obtiene a partir de la ecuación
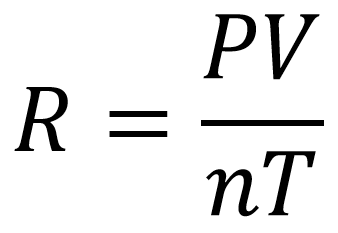
Las condiciones estándar para poder determinar la constante son:

Reemplazando los valores se tiene que
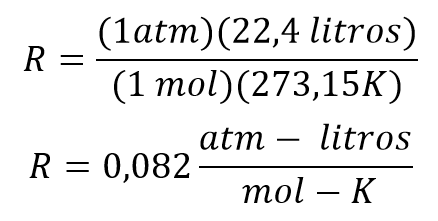
Una vez se tiene este principio se pueden determinar los valores de la constante R para diferentes unidades de presión, volumen y temperatura, de este modo se obtiene la tabla que se presenta a continuación
Ejercicios resueltos
Cuando se trata de desarrollar ejercicios de gases ideales siempre se va a tener una incógnita que puede ser presión, volumen, número de moles o temperatura, vamos a resolver cada tipo de ellos.
Primer tipo de ejercicios: Calcular la presión
500 gramos de dióxido de carbono se encuentran a una temperatura de 200 °C ocupando un volumen de 50 litros ¿Cuál es la presión en atm?
Solución
Para utilizar la ecuación de gases ideales es necesario conocer el número de moles del gas, en este caso el ejercicio dice que se cuentan con 500 gramos de dióxido de carbono por lo que debemos convertir esa masa a moles con la ayuda del peso molecular.
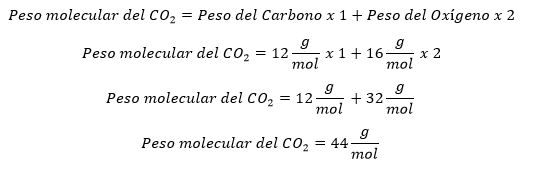
Una vez se conoce el peso molecular del CO2 se procede a calcular el número de moles que hay en los 500 gramos.
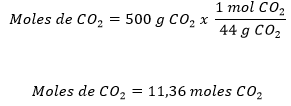
Una vez se conocen el número de moles se prcede a reemplazar los valores, sin embargo se debe hacer una aclaración y es que en las ecuaciones de gases ideales NUNCA se utilizan los °C por lo que debemos pasar de °C a K.
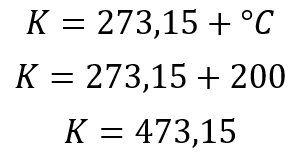
Luego se tiene la ecuación general
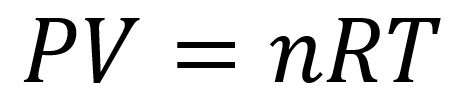
y se despeja la presión
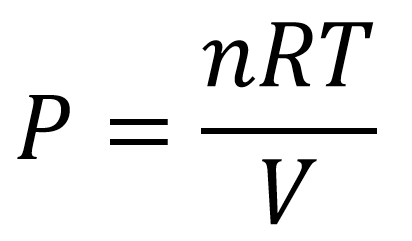
Luego se reemplazan los valores, es importante saber determinar el valor de la constante R, para este caso como el ejercicio nos pide la presión en atm y el volumen está en litros el valor de R debe ser 0,0082057 atm-litro/mol – K
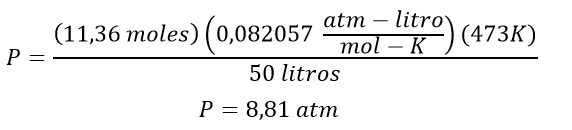
Segundo tipo de ejercicios: Calcular el volumen
Se tienen 100 moles de un gas confinandas en un cilindro a una presión de 2000 mm Hg y una temperatura de 400 K ¿Qué volumen tiene el cilindro? exprese la respuesta en metros cúbicos.
Solución
Se plantea la ecuación para la solución del ejercicio
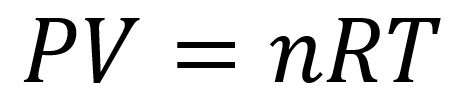
A partir de la ecuación se despeja el volumen quedando
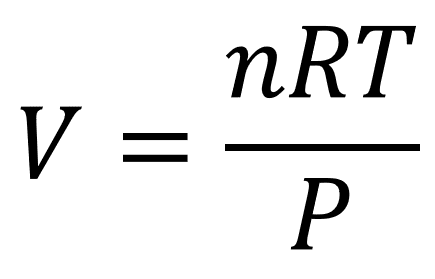
Una vez despejada se procede a reemplazar los valores, para este caso como la presión se encuentra en mmHg, la temperatura en Kelvin y el resultado del volumen debe presentarse en metros cúbicos el valor de la constante R a utilizar es de 0,062361 mmHg – m3 / mol – K
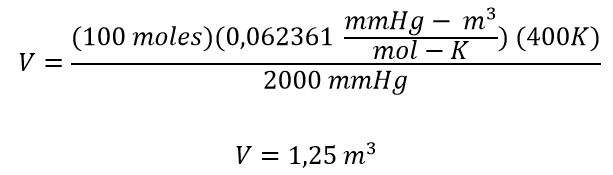
Tercer tipo de ejercicios: Calcular la temperatura
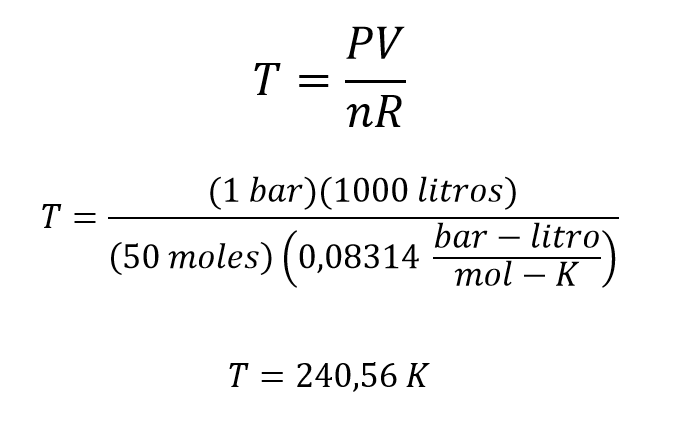
50 moles de oxígeno están en un tanque de 1000 litros a una presión de 1 bar ¿a qué temperatura se encuentra el oxígeno?
Solución
Se plantea la ecuación
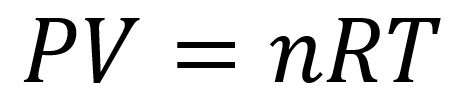
A partir de la ecuación se despeja la temperatura y se reemplazan los valores conocidos, en este caso el valor de R es de 0,08314 bar – litro / mol- K debido a las unidades de presión y temperatura que se tienen
Cuarto tipo de ejercicios: Calcular el número de moles
¿Cuántas moles hay en un recipiente de 2 metros cúbicos que contiene un gas a una presión de 500 000 pascales y una temperatura de 300 K?
Solución
Se plantea la ecuación
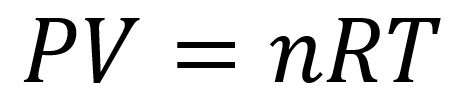
En este ejercicio se pide el número de moles por lo que es necesario despejar n, la presión está en pascales, el volumen en metros cúbicos y la temperatura en Kelvin por lo que la constante R que se utiliza es 8,314472 Pascal – metro cúbico / mol – Kelvin