La Ecuación de Boyle o ley de Boyle describe la relación entre la presión y el volumen de un gas cuando la temperatura y el número de moles son constantes (es decir en procesos isotérmicos y de masa constante).
Tabla de contenidos
Fórmula general de la ley de Boyle
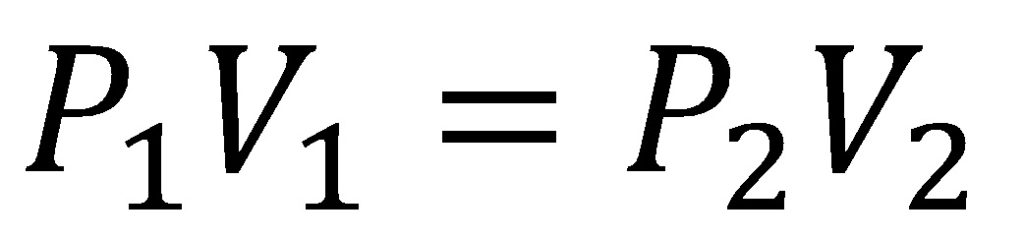
Explicación de la ley
Robert Boyle descubrió que al aumentar la presión de un gas el volumen disminuía de forma proporcional, es decir al aumentar la presión al doble el volumen se reducía a la mitad, al aumentar la presión diez veces así mismo el volumen se reducirá en una décima parte, siempre se cumple esa proporcionalidad, de allí nace la fórmula de la ley de Boyle anteriormente mostrada.
Gráfica de la ley de Boyle
Para visualizar la ley de Boyle los resultados del volumen y la presión se grafican y de este modo se puede evidenciar la relación entre esas variables.
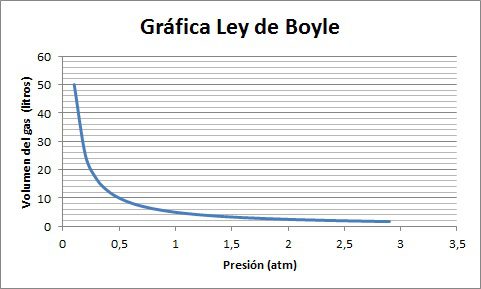
En la gráfica de la Ley de Boyle se puede observar un comportamiento tipo exponencial entre el volumen y la presión de un gas. De acuerdo con el enunciado de la ley de Boyle, a mayor presión menor es el volumen y viceversa, analizando la gráfica también se puede llegar a la conclusión que aunque se aumente de forma exagerada la presión cada vez el cambio del volumen será menor, los grandes cambios en el volumen se pueden evidenciar a presiones bajas.
Experimentos ley de Boyle
La historia nos cuenta que para demostrar su ley, Boyle recurrió en 1662 a un experimento basado en un émbolo con un pistón donde podía cambiar la presión del gas y evidenciaba el volumen que este ocupaba, de forma independiente otro cientifico francés llamado Edeme Mariotte realizó el mismo experimento de allí que a esta ley también se le conoce como la ley de Boyle-Mariotte. El resultado del experimento fue el siguiente:
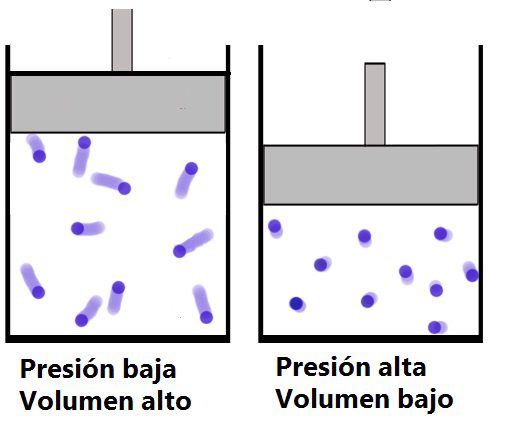
Efectivamente se cumple el postulado donde a una presión baja el volumen que ocupa el gas es alto mientras que a una presión alta el volumen que ocupa es bajo.
Aplicaciones de la ley de Boyle
Hoy en día son muchas las aplicaciones en las que se puede evidenciar la ley de Boyle, entre otras se encuentran:
- Presiones de gases dentro de tanques como por ejemplo los cilindros de gas propano.
- Automatización de procesos a través de pistones y émbolos a los cuales se les regula la presión.
- Presiones de succión con jeringas
- Juegos de inflar globos (Ley de boyle para niños)
- Cálculos de cantidad de aire en lugares confinados.
- Cálculo de presiones necesarias para procesos de inyección de plásticos
- Control de presiones de salida de gas metano en la industria petrolera, entre otros.
Ejemplos resueltos ley de Boyle
Los ejercicios más comunes en la ley de Boyle son cuatro, el primero donde se pide calcular el volumen final de un gas luego de comprimirse o descomprimirse
El segundo donde se pide calcular la presión final del gas cuando se aumenta o se disminuye el volumen.
En el tercero lo que se pide es calcular la presión inicial de un gas y en el cuarto se pide despejar el volumen inicial.
Sabemos que son varios tipos de ejercicios pero tranquilo, aquí te presentamos la respuesta para cada uno de ellos.
Primer tipo de ejercicios: Cálculo de volumen final
En este tipo de ejercicios la pregunta que se realiza es ¿Cuál es el volumen final del gas después de un proceso de compresión o descompresión?, tranquilo aquí te mostraremos cómo resolverlos, para ello debemos despejar la ecuación de tal modo que podamos encontrar el volumen final así:
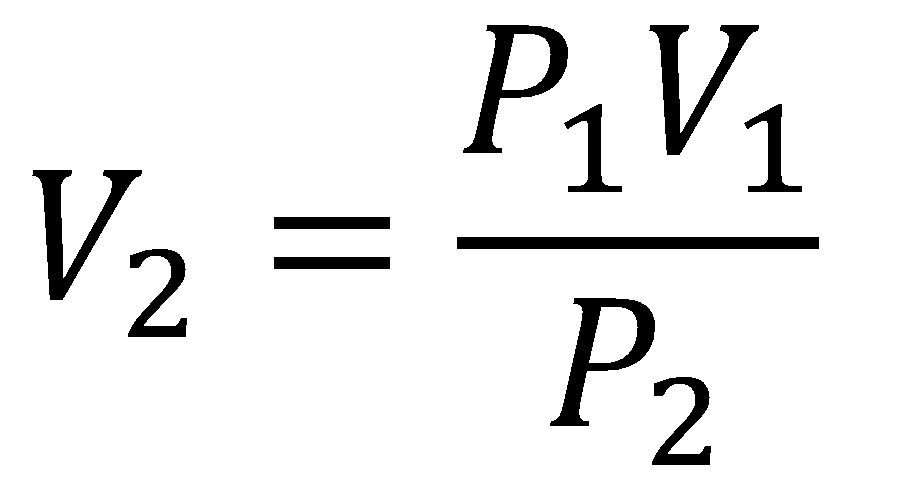
compresión de un gas
Un gas que ocupa un volumen de 5 litros y tiene una presión de 10 atm se comprime hasta llegar a 50 atm ¿Cuál será el volumen final del gas?
Respuesta:
Utilizamos la ecuación de volumen final de la ley de Boyle y reemplazamos los valores
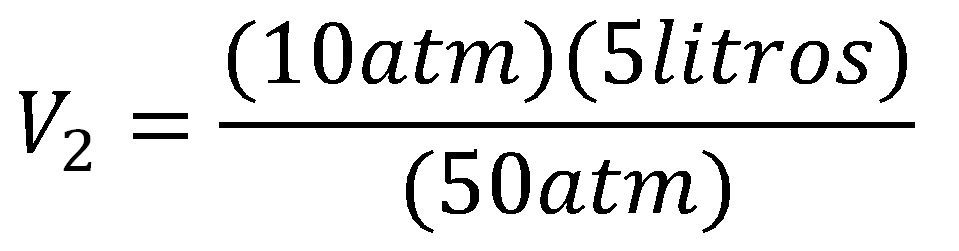
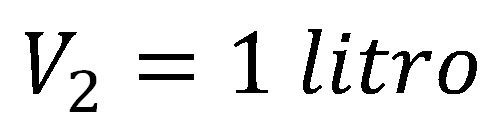
descompresión de un gas
Un gas que ocupa un volumen de 45 litros y tiene una presión de 200 atm se descomprime hasta llegar a 2 atm ¿Cuál será el volumen final del gas?
Respuesta:
Utilizamos la ecuación de volumen final de la ley de Boyle y reemplazamos los valores
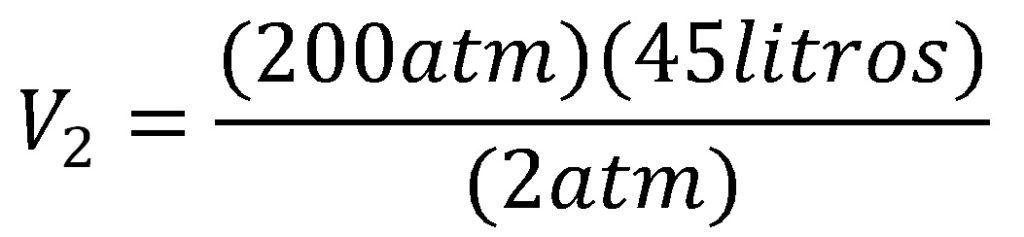
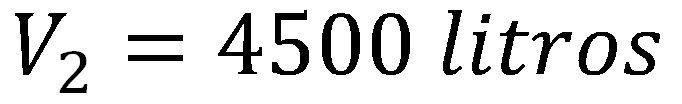
Segundo tipo de ejercicios: Cálculo de presión final
Ahora vamos a solucionar el tipo de ejercicios donde la pregunta que se realiza es ¿Cuál es la presión del gas después de que se varía su volumen? al igual que en el primer tipo de ejercicios debemos despejar la ecuación de tal modo que podamos encontrar la presión final así:
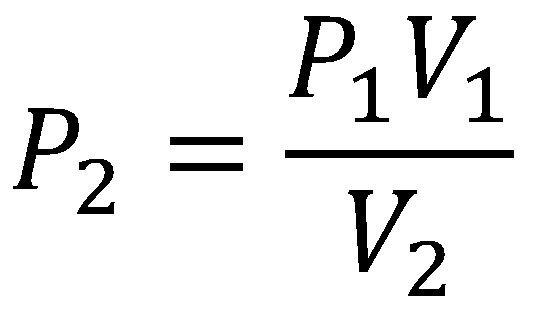
Aumento o disminución del volumen de un gas
Un gas se encuentra confinado en un tanque cuyo volumen son 500 litros y su presión es de 400mmHg, ¿qué presión tendrá si se aumenta el volumen del tanque a 1000 litros?
Respuesta:
Finalmente utilizamos la ecuación de presión final y reemplazamos los valores
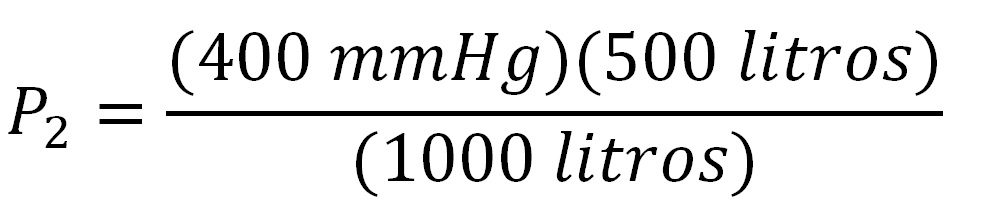
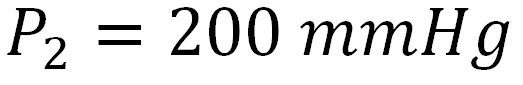
Tercer tipo de ejercicios: Cálculo de presión inicial
Para solucionar este tipo de ejercicios lo primero que se debe hacer es despejar la presión inicial de la ecuación de Boyle, de este modo:
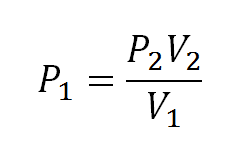
Los ejercicios tipo de este caso serán:
Un gas comprimido en un tanque ocupa un volumen de 4 litros, para utilizarlo se libera a un espacio donde la presión son 0,8 atmosferas y a esta nueva presión ocupa un volumen de 24 litros ¿Cuál era la presión inicial?
Respuesta:
Se utiliza la ecuación donde la presión inicial está despejada y se reemplazan valores quedando así:
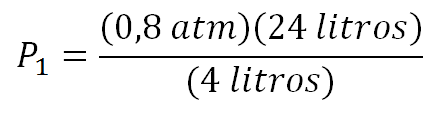
Calculando se obtiene entonces que la presión inicial es:
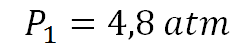
Cuarto tipo de ejercicios: Cuando se pide despejar el volumen inicial
Para solucionar este tipo de ejercicios lo primero que se debe hacer es despejar el volumen inicial de la ecuación de Boyle, de este modo:
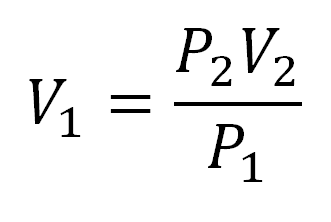
Los ejercicios tipo de este caso tienen la siguiente estructura:
Un gas se encuentra confinado en un tanque de volumen desconocido a una presión de 10 atmosferas, el gas se libera hasta que tiene una presión de 2 atmosferas y un volumen de 500 litros ¿Cuál era el volumen inicial del gas?
Respuesta:
Se utiliza la ecuación donde el volumen inicial está despejada y se reemplazan valores quedando así:
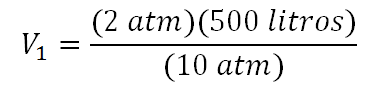
Resolviendo esto entonces el volumen inicial es:
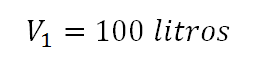
Ejercicios propuestos
Ejercicios propuestos del primer tipo
Primer tipo de ejercicios con compresión – Ley de Boyle
Primer tipo de ejercicios con descompresión – Ley de Boyle
Segundo tipo
Segundo tipo de ejercicios – Ley de Boyle
Ejercicios propuestos del tercer tipo
Tercer tipo de ejercicios – Ley de Boyle
Cuarto tipo
Cuarto tipo de ejercicios – Ley de Boyle
¿Cómo referenciarnos?
Munévar, R. (S.F) Ley de Boyle. ecuacionde.com. Recuperado el día (fecha en la que nos consultas) de https://ecuacionde.com/boyle
Recuerda que si tienes dudas frente a este tema o cualquier otro tema relacionado con ecuaciones puedes dejar tu pregunta en los comentarios o en nuestra página de contacto

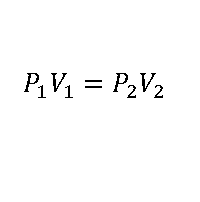
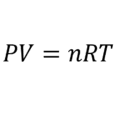
Todo bien explicado y me sirvió para refrescar los conocimientos.
Muchas gracias, me sirvió mucho la información.
Me gusta mucho la explicación, entendí super fácil
me sirvió mucho.
Gracias!!! sigue subiendo información así es de gran ayuda.
muy buena información, me funcionaron las explicación para lograr entender el tema
Gracias por la información es bastante concreta y se encuentra todo lo que se necesita.
Excelente infromacion, bien explicado y conciso.
Gracias.
Muchas gracias en verdad me sirvió mucho para el trabajo que estoy desatollando
Es de mucha utilidad esta página se me facilitó para realizar mi trabajo.
Gracias, muy bien explicado!
Muy buena información , bien explicado , me sirvió mucho.
Nunca he visto algo tan bien explicado, muchas gracias me ayudo a aclarar varias dudas
muchas gracias me sirvió de mucho par realizar mi trabajo
Muchas gracias, me sirvió mucho la información.
Me gusta mucho la explicación, entendí super fácil
Excelente información, fue de gran ayuda para mi trabajo.
muchas gracias me sirvió mucho para mi trabajo