La Ecuación o ley de Gay Lussac describe la relación entre la presión y la temperatura de un gas cuando el volumen y el número de moles son constantes (es decir en procesos isocóricos y de masa constante).
Tabla de contenidos
Fórmula general
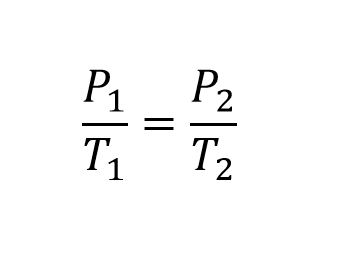
Explicación
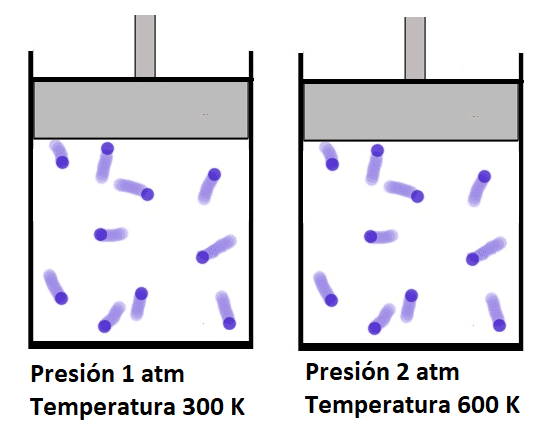
A principios de 1800 el científico francés Louis Joseph Gay Lussac demostró que un gas aumenta su presión a medida que aumenta la temperatura si el volumen y la masa se mantienen constantes.
El incremento de la presión ocurre porque al aumentar la temperatura la velocidad de las moléculas del gas aumenta lo que hace que el golpe que efectúan sobre la pared del recipiente que contiene el gas sea más fuerte, a mayor fuerza en el golpe, mayor será la presión.
El fenómeno que ocurre tiene diferentes condiciones a los establecidos por ejemplo en la Ley de Boyle o en la Ley de Charles por lo que es importante no confundirlos.
Gráfica de la ley
Para visualizar la ley deLussac los resultados de la presión y la temperatura se grafican y de este modo se puede evidenciar la relación entre esas variables.
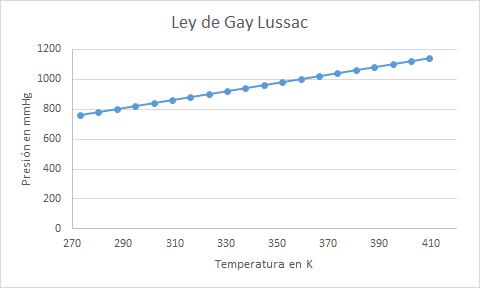
En la gráfica de la ley de Gay Lussac se puede observar un comportamiento lineal en el comportamiento de la presión frente a la temperatura, a medida que se va calentando el gas en un recipiente que no varía el volumen la presión también se incrementa paulatinamente. de forma análoga se puede concluir que al reducir la temperatura de un gas confinado en un espacio cerrado la presión disminuirá proporcionalmente.
A partir de la ley de Gay Lussac se puede establecer que controlar la temperatura es una buena estrategia para determinar la presión en un proceso determinado, por ejemplo si se requiere que un gas confinado en un cilindro mantenga una presión baja para evitar que estalle se puede controlar su presión enfriando el ambiente.
Aplicaciones de la ley de Gay Lussac
Hoy en día son muchas las aplicaciones en las que se puede evidenciar la ley de Charles, entre otras se encuentran:
- Presiones de gases dentro de tanques como por ejemplo los cilindros de gas propano.
- Cocción de alimentos a altas presiones y altas temperaturas, por ejemplo en ollas a presión
- Cálculo de presiones dentro de reactores
Ejemplos resueltos ley de Gay Lussac
Si te gusta la resolución de ejemplos de una forma más visual tenemos la explicación para ti, puedes verla aquí: Ley de Gay Lussac en Youtube
Los ejercicios más comunes en esta ley son cuatro, el primero donde se pide calcular la temperatura final de un gas luego de aumentar o disminuir la presión.
El segundo donde se pide calcular la presión final del gas cuando se aumenta o se disminuye la temperatura.
En el tercero lo que se pide es calcular la presión inicial de un gas y en el cuarto se pide despejar la temperatura inicial.
Sabemos que son varios tipos de ejercicios pero tranquilo, aquí te presentamos la respuesta para cada uno de ellos.
Primer tipo de ejercicios: Cálculo de temperatura final
En este tipo de ejercicios la pregunta que se realiza es ¿Cuál es la temperatura final del gas después de un aumento o disminución de la presión?, tranquilo aquí te mostraremos cómo resolverlos.
Ejercicio:
Un gas que se encuentra a una presión de 1000 mm Hg y una temperatura de 100°C se comprime hasta llegar a 5000 mmHg ¿cuál será la temperatura final de este gas?
Solución:
El primer paso es plantear la ley de Gay Lussac para determinar la relación que existe entre las presiones y las temperaturas
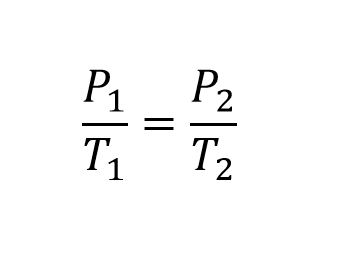
A partir de la ecuación de la ley de Gay Lussac se despeja la temperatura final quedando la ecuación:
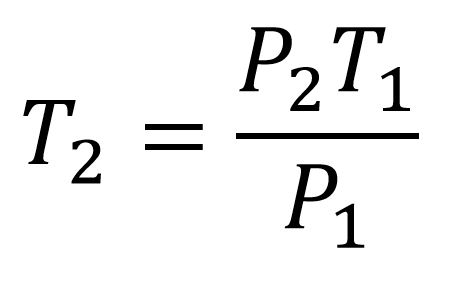
Lo primero que se debe tener en cuenta es que en las ecuaciones de gases NUNCA se utilizan los grados Celsius, SIEMPRE se trabaja con Kelvin.
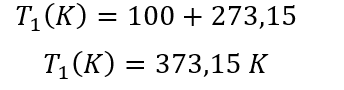
Una vez se tiene la temperatura en Kelvin se procede a reemplazar los valores en la ecuación de temperatura final despejada de Gay Lussac y se calcula la solución
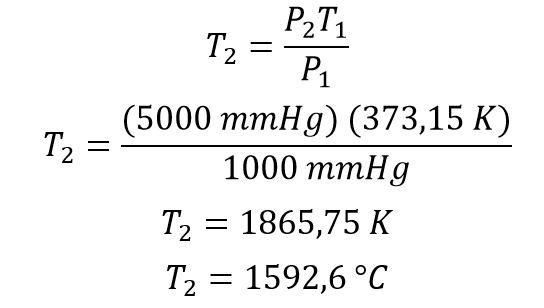
La temperatura final del gas es 1592 °C
Segundo tipo de ejercicios: Cálculo de presión final
Ejercicio
Un gas se encuentra a una presión de 25 atmósferas y una temperatura de 400 K ¿Cuál será la presión si la temperatura se incrementa a 1200 K?
Solución
El primer paso es plantear la ecuación de Gay Lussac para determinar la relación que existe entre las presiones y las temperaturas
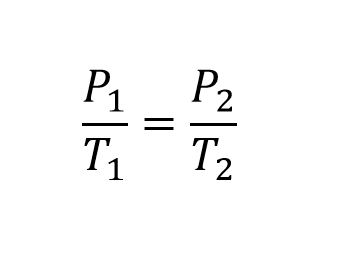
A partir de la ecuación de Gay Lussac se despeja la presión final quedando la ecuación:
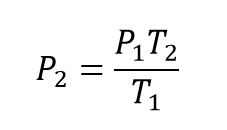
Una vez se tiene la ecuación despejada para obtener la presión final se reemplazan los valores correspondientes quedando
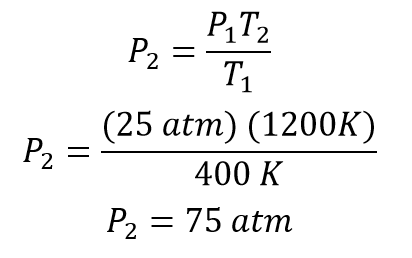
La presión después del calentamiento del gas será de 75 atmósferas.
Tercer tipo de ejercicios: Cálculo de presión inicial
Ejercicio
Un gas se encuentra a una temperatura de 800 K cuando es enfriado hasta los 300 K, a esta temperatura su presión es de 100 PSI ¿Cuál era la presión inicial?
Solución
El primer paso es plantear la ley de Gay Lussac para determinar la relación que existe entre las presiones y las temperaturas
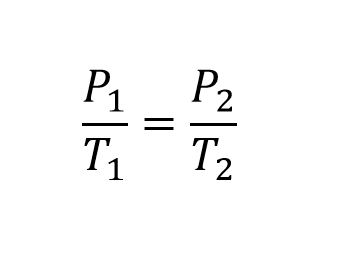
A partir de la ecuación de la ley de Gay Lussac se despeja la presión inicial quedando la ecuación:
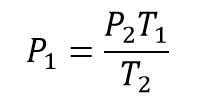
Una vez se tiene la ecuación despejada para obtener la presión inicial se reemplazan los valores correspondientes quedando
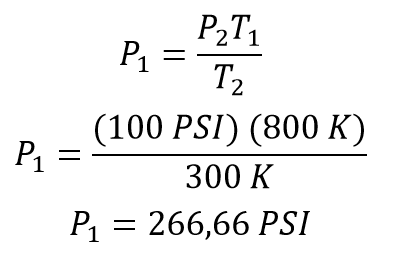
La presión inicial del gas eran 266,66 PSI
Cuarto tipo de ejercicios: Cálculo de temperatura inicial
Ejercicio
Un gas se encuentra a una presión de 10 bar y una temperatura inicial desconocida es calentado hasta 650 K, a esta temperatura su presión es de 85 bar ¿Cuál era la temperatura inicial?
Solución
El primer paso es plantear la ley de Gay Lussac para determinar la relación que existe entre las presiones y las temperaturas
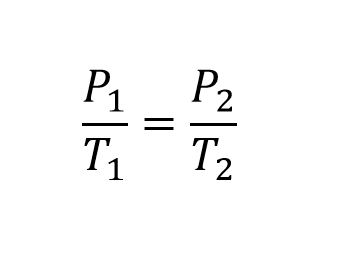
Una vez se tiene la ecuación despejada para obtener la temperatura inicial se reemplazan los valores correspondientes quedando
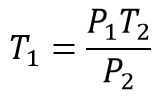
Ahora se procede a reemplazar los valores
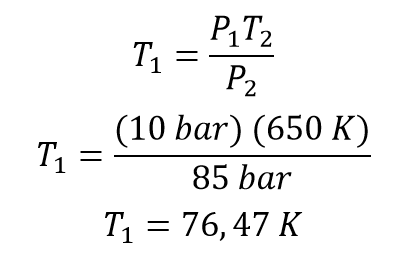
La temperatura inicial del gas era de 76,47 Kelvin
¿Cómo referenciarnos?
Munévar, R. (S.F) Ley de Gay Lussac. ecuacionde.com. Recuperado el día (fecha en la que nos consultas) de https://ecuacionde.com/gay-lussac
Recuerda que si tienes dudas frente a este tema o cualquier otro tema relacionado con ecuaciones puedes dejar tu pregunta en los comentarios o en nuestra página de contacto